纳米技术与生物传感器
一、引言
纳米技术
(nanometer technology)
主要是针对尺度为
1nm~100nm
之间的分子世界的一门技术。该尺寸处在原子、分子为代表的微观世界和宏观物体交界的过渡区域,基于此尺寸的系统既非典型的微观系统亦非典型的宏观系统,因此有着独特的化学性质和物理性质,如表面效应、微尺寸效应、量子效应和宏观量子隧道效应等。
纳米技术引入生物传感器领域后,提高了生物传感器的检测性能,并促发了新型的生物传感器。因为具有了亚微米的尺寸、换能器、探针或者纳米微系统,生物传感器的化学和物理性质和其对生物分子或者细胞的检测灵敏度大幅提高,检测的反应时间也得以缩短,并且可以实现高通量的实时检测分析。本文就纳米技术在生物传感器中的应用作一介绍,包括多种纳米结构的性能和制作。
二、纳米结构
纳米结构在生物传感器中应用非常广泛,纳米结构可以是管道、纤维、颗粒、光纤以及薄膜和多孔体等。下面就不同纳米结构在生物传感器中应用分别进行介绍。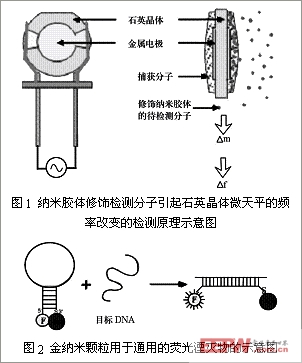

1
、纳米颗粒在生物传感器中的应用
关于纳米颗粒的研究很多,例如将功能性纳米颗粒
(
如电子性质的、光学性质的和磁性的
)
固定在生物大分子
(
如多肽、蛋白、核酸
)
上,可制成用于生物信号检测、信号转换和放大的传感器,其可分为声波、光学、磁性和电化学等种类。
(
1
)声波生物传感器
声波生物传感器是检测待检测物质引起声波频率改变的传感器。其中,被研究最多的是石英晶体微天平
(quartz crystal microbalance, QCM)
生物传感器。其压电晶体常用
AT
方式
(
AT
切割指切割面与石英晶体主光轴成
25.15
°,此刻,在室温下晶体共振温度系数接近于零
)
,在晶体的两面则采用离子束沉积等方法形成两个平行金属
(Au
,
Ag
,
Pt
,
Ni
,
Pd
等
)
膜电极。膜电极的表面固定识别分子,识别分子因其有特异性而结合待检测分子,引起电极表面的质量变化,从而改变石英晶体的振荡频率。如果在待检测分子上修饰纳米颗粒,
会显著提高待检测分子的质量,则检测信号也随之增强。
Ward[1]
等人用纳米胶颗粒标记抗体,通过抗体-抗原免疫方法将其结合到石英晶体表面,由于修饰胶体颗粒
(
溶胶颗粒的直径在
5~100nm)
提高了标记分子的质量,根据
Sauerbrey
方程,石英晶体的振荡频率也相应得以提高,因而检测信号被放大,检测灵敏度提高,检测下限也降低了。
(
2
)光学生物传感器
纳米金属颗粒可以用于光共振检测,
Bauer[2]
等人通过抗原-抗体或蛋白-受体结合等方法在导电材料表面固定纳米金属颗粒团,由于纳米颗粒反射偶极子的相互作用,引起反射光的共振增强,通过检测共振信号即可探知待检测物质。纳米颗粒也可以用来定位肿瘤,荧光素标记的识别因子与肿瘤受体结合,然后在体外用仪器显示出肿瘤的大小和位置。
纳米金属颗粒还可以作为一种通用的荧光湮灭基团。
Maxwell[3]
等人在寡核甘酸探针分子的两端分别标记纳米金颗粒和荧光激发基团,探针由于碱基互补形成“发卡”结构,荧光激发基团和纳米金颗粒靠近,引起激发荧光湮灭;而当探针与特异性靶
DNA
结合后,其构象发生变化,纳米金颗粒和荧光激发基团分离,从而激发出荧光。该原理可用于
核酸的实时荧光检测,以及单碱基突变多态性检测等。
(
3
)磁性生物传感器
磁性纳米颗粒在生物检测和药物分析上有着重要的应用价值。通过磁性材料标记生物分子,结合分子识别技术,可以实现样品的混合、分离、检测等复杂操作。
Šafařík
和
Šafaříková
[4]Richardson[5]等人通过磁免疫分析技术,用磁力计数器检测磁性标记分子。另外,用纳米磁性颗粒标记识别因子,与肿瘤表面的靶标识别器结合后,可在体外测定磁性颗粒在体内的分布和位置,从而给肿瘤定位。
等人用磁性材料标记分子,在磁场梯度下实现样品的分离和检测。
Chemla[6]
等人利用顺磁性的纳米颗粒和基于高温瞬态直流超导量子界面装置
(superconducting quantum interference device
,
SQUID)
的显微镜,提出了一种新颖的生物样品的快速检测技术。首先,把固定抗体的磁性颗粒悬浮在溶液中,然后在瞬时磁场脉冲下,磁化纳米颗粒产生,当磁场消失时,颗粒趋向自由分布,因为没有结合抗体的颗粒呈布朗运动,所以没有检测信号;而结合靶分子的纳米颗粒按照
Neel
松弛方式运动,产生一个缓慢衰减的磁信号,通过
SQUID
采集的信号即可分析出待检测物质。该技术无需分离未结合待检测分子的纳米颗粒,可以直接检测标记分子,缩短了检测时间,提高了检测效率。
(
4
)电化学生物传感器
胶体金是最常见的金属纳米颗粒,可以用于生物分子的标记,从而实现信号的检测和放大;此外,它还可广泛应用于
TEM
、
SEM
表征和试纸条显色等方面。许多文献也报道了胶体金在各种生物传感器中的信号放大作用。
Gonzalez-Garcia[7]
等人利用胶体金标记,结合电化学方法来研究生物素—亲和素之间的作用。通过把生物素化的白蛋白修饰在电极表面,然后与
10nm
直径胶体金标记的亲和素反应,发现由胶体金引起的电流响应和亲和素浓度线性相关
(2.5
×
10-9mol/L ~2.5
×
10–5mol/L)
。
纳米粒子具有极佳的比表面积,可用于生物分子的固定,能增加固定的分子数量,从而实现信号的放大。
Singh
等人用
sol-gel
方法合成硅纳米颗粒,其直径为
20nm
或
200nm
。在纳米颗粒表面固定乙酰胆碱脂酶,可用于制造有机磷农药生物传感器,由于具有较高的比表面活性,结合离子敏场效应管检测,响应迅速
(10s)
,灵敏度高,对
paraoxon
杀虫剂的检测下限可达
1
×
10-6mol/L
。
Cai[8]
等人把胶体金纳米颗粒固定在胱氨酸修饰的金电极表面,增加了
ssDNA
探针的固定效率,提高了检测的灵敏度。
金属纳米颗粒作为催化剂的载体,可以大大提高催化剂的性能。酶-胶体金固定在电极表面,可用于
H2O2
、葡萄糖、黄嘌呤、次黄嘌呤等电化学检测。
Xu[9]
等人在丝网印刷的碳电极表面用胶体金修饰,结合免疫结合山葵过氧化酶
(HRP)
制作
H2O2
生物传感器,结果发现
HRP
的电催化性能和电流响应显著改善,信号线性范围有了很大的提高
(0.8μM~1.0mM)
,检测下限也降低至
0.4μM
。
2
、纳米导线
采用搀硼硅
(silicon nanowires
,
SiNWs)
制作而成的纳米导线,可以提高生物传感器的电化学检测灵敏
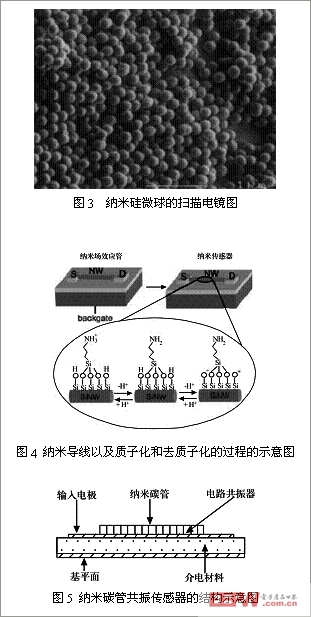 度。
Cui[10]
等人用胺和羟基修饰
SiNWs
,制作成纳米
PH
计。由于导线表面修饰基团在溶液中的质子化和去质子化,引起导线的电导率改变,而导线的电导率与溶液的
PH
值呈线性关系,因此可以探测环境中的
PH
测量。另外,
Cui
等人用生物素修饰的
SiNWs
可以检测到
pmol
浓度的链霉素抗生物素蛋白。固定抗原的
SiNWs
还可用于抗体的可逆结合和实时定量检测。研究表明,半导体的纳米导线可以制作高灵敏度、无标记和实时检测的生物传感器及其阵列。
度。
Cui[10]
等人用胺和羟基修饰
SiNWs
,制作成纳米
PH
计。由于导线表面修饰基团在溶液中的质子化和去质子化,引起导线的电导率改变,而导线的电导率与溶液的
PH
值呈线性关系,因此可以探测环境中的
PH
测量。另外,
Cui
等人用生物素修饰的
SiNWs
可以检测到
pmol
浓度的链霉素抗生物素蛋白。固定抗原的
SiNWs
还可用于抗体的可逆结合和实时定量检测。研究表明,半导体的纳米导线可以制作高灵敏度、无标记和实时检测的生物传感器及其阵列。
 度。
Cui[10]
等人用胺和羟基修饰
SiNWs
,制作成纳米
PH
计。由于导线表面修饰基团在溶液中的质子化和去质子化,引起导线的电导率改变,而导线的电导率与溶液的
PH
值呈线性关系,因此可以探测环境中的
PH
测量。另外,
Cui
等人用生物素修饰的
SiNWs
可以检测到
pmol
浓度的链霉素抗生物素蛋白。固定抗原的
SiNWs
还可用于抗体的可逆结合和实时定量检测。研究表明,半导体的纳米导线可以制作高灵敏度、无标记和实时检测的生物传感器及其阵列。
度。
Cui[10]
等人用胺和羟基修饰
SiNWs
,制作成纳米
PH
计。由于导线表面修饰基团在溶液中的质子化和去质子化,引起导线的电导率改变,而导线的电导率与溶液的
PH
值呈线性关系,因此可以探测环境中的
PH
测量。另外,
Cui
等人用生物素修饰的
SiNWs
可以检测到
pmol
浓度的链霉素抗生物素蛋白。固定抗原的
SiNWs
还可用于抗体的可逆结合和实时定量检测。研究表明,半导体的纳米导线可以制作高灵敏度、无标记和实时检测的生物传感器及其阵列。
3
、纳米微管和多孔纳米结构
微管和
多孔结构可以保持生物分子的活性和提高分子的固定效率,而采用尺寸更小、比表面积更大的纳米微结构,可以进一步改善生物传感器的性能。
(
1
)纳米微管
纳米微管的研究报道很多,其中,以碳纳米管的研究最热。碳纳米管有着优异的表面化学性能和良好的电学性能,是制作生物传感器的理想材料。无论是单层碳纳米管
(
single-wall nanotubes
,
SWNT)
还是多层碳纳米管
(
multi-wall nanotubes
,
MWNT)
在生物传感器中都有应用。与常规的固态碳传感器相比,碳纳米管制作的生物传感器的灵敏度高、反应速度快,检测温度范围广。据报道,
Azamian
等人
[11]SWNT表面固定葡萄糖氧化酶,使酶的催化活性比普通碳电极固定的酶的催化活性提高1个数量级。K. Aihara[12]等人制作了微波碳纳米管电磁共振生物传感器,用于气体和生物分子的灵敏检测。他们将长3μm~10μm直径1.4nm~25nm的SWNTs固定在微加工的电磁共振器的表面,在不同的有机气体环境中,共振器表面吸收有机气体引起共振频率改变,例如,异丙醇(IPA)使传感器的共振频率迁移2MHz~3MHz;而当恢复原来气体环境时,传感器的共振频率逐渐恢复。
曾在
Miao[13]
等人发现了一种聚吡咯
(polypyrrole)
纳米微管。利用化学或电化学方法使吡咯单体在模板孔隙中生长,可得到与模板相应结构的纳米管。这种微管具有统一直径、上下连通、管壁多孔的特点。它具有较大的比表面积,能容纳大量的酶分子,并减少反应物和产物的扩散障碍,有效地提高酶电极的性能。
(
2
)纳米多孔硅
对单晶硅进行电化学腐蚀可以得到具有纳米孔径的多孔硅,这种材料在室温下可发射可见光,具有高比表面积
(500m2/cm3)
以及与现有硅加工技术相容等优点。前一优点增加了可固定敏感分子的数量,从而提高了灵敏度,后一优点则便于各种形式的微加工和大规模生产。在多孔硅的表面固定寡核苷酸、生物素或者抗体等识别分子,通过检测光干涉和折射率的变化,从而能构建一种新型的免标记生物传感器
[14]cDNA的检测,灵敏度可达194. 2fmol/L。
。其可用于
4
、光纤纳米生物传感器
与其它类型的生物传感器相比,光纤纳米生物传感器非但体积微小、灵敏度高,而且不受电磁场干扰,不需要参比器件。它可以进入细胞内部,对细胞内结构和细胞质的变化进行在线体测量。
(
1
)光纤纳米荧光生物传感器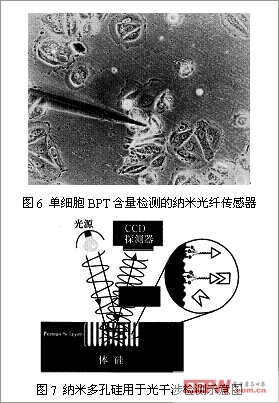

Kopelman[15-16]
最早使用了荧光法的光纤纳米传感器,以检测微环境中的
PH
值。其工作原理是在光纤头部固定荧光剂,在荧光剂与质子发生可逆反应时,液体光学性质发生变化,根据荧光强度的变化即可测定
PH
值。光纤处理的方法如下:用光纤拉制仪将光纤拉制成头部直径为
100nm~1000nm
的光纤探针,用真空蒸发器在光纤表面镀上铝,以防止光在传输过程中外泄,然后将暴露的光纤头部硅烷化,表面修饰成含羟基或氨基的活性表面,固定识别待检测分子的抗原或抗体,最后在光纤头部结合上一种
PH
选择性荧光染料聚合物。该纳米传感器响应时间为
250ms
,可以检测浓度为
μM
的离子。这些特性适宜于对单个细胞和亚细胞结构的检测,例如进行小鼠胚胎细胞液
PH
值的检测。
(
2
)光纤纳米免疫生物传感器
光纤纳米免疫传感器是将光学与光子学技术应用于免疫法,利用抗原抗体能发生特异性结合的性质,将感受到的抗原量或抗体量转换成光学信号的一类传感器,这类传感器集传统的免疫测试法与光学、生物传感技术的优点集一身,具有很高的特异性、敏感性和稳定性。同时,光纤纳米免疫传感器只是在将敏感部件上使用了纳米产品,因此既保留了原来的诸多优点,又使之能适用于单个细胞的测量。
Dinh[17-18]
等人成功地研制出一种用于检测
BPT(Benzo pyrene tetrol
,是一种与暴露于致癌物质苯并
[α]
芘相关的
DNA
损伤的生物标志物
)
的光纤纳米免疫传感器。他们首先用光纤拉制仪制作直径
10nm~100nm
的石英光纤,然后将光纤头部硅烷化,并用
BPT
的抗体修饰光纤头部,随后将光纤全长
(
修饰的光纤头部除外
)
镀银以防止光漏出,最后在单细胞操作的显微操纵仪
/
显微注射器上进行细胞穿刺及检测实验,用光电倍增管
PMT
记录
BPT
与抗体结合后产生的荧光,通过测定荧光强度的变化检测细胞内
BPT
的含量。该传感器的最低检出限可以达到
10–21mol
。
5
、纳米微加工
纳米微加工技术融合了
IC
工艺和
MEMS
工艺,主要包括光刻、薄膜的生长
/
淀积、离子注入、腐蚀和键合等四个加工步骤。近年来,分子自组装成为微细加工发展的新方向。

L. Malaquin[19]
等人采用电子束光刻工艺制作纳米电极。在光滑的硅衬底材料上,用电子束曝光、剥离
(Lift-off)
等工艺制作出金纳米电极结构,最小线宽可以达到
20nm
。该纳米电极可用于直径为
100nm
胶体金的电化学检测。
IBM
公司和瑞典
Basel[20]
大学的研究人员正在开发一种新型的纳米微悬梁生物传感器,利用
DNA
分子的双螺旋机构作为分子特异性识别能力的模型。器件的核心是硅悬梁天平阵列,长
500μm
,宽
100μm
,厚度为
1μm
。当生物分子结合时,悬梁臂开始弯曲,通过激光反射技术,
10nm~20nm
的弯曲都能被检测到。在悬梁天平阵列表面固定具有不同识别性的分子,构成阵列式生物传感器,可以同时检测多项指标。
美国
Naval[21]
研究实验室进一步改进了悬臂梁生物传感器,提出了磁力放大生物传感器
(
force amplified biological Sensor
,
FABS)
的概念。通过待测样品分子免疫结合微磁珠,在悬臂梁的垂直方向引入磁场,微磁珠由于受到磁力作用,引起悬梁臂的弯曲。由于用力量较大的磁场力代替原来较弱的重力,检测灵敏度可以达到
10-18M
。
三、结束语
纳米技术和生命科学是
21
世纪最前沿的两大学科,纳米技术的介入为生物传感器的发展提供了无穷的想象空间。总的说来,纳米颗粒可以广泛地应用于敏感分子的固定
(
纳米金、碳纳米管
)
、信号的检测和放大
(
纳米金、纳米磁粒子、荧光纳米颗粒
)
、待侧物质的富集和浓缩
(
纳米磁粒子
)
。由于纳米结构有着优异的化学和物理性能,有着极高的比表面,有利于提高敏感分子的吸附能力,并能提高生化反应的速度,因此被广泛用于生物传感器表面吸附层的制作,例如表面薄膜共振
SPR
检测的等离子共振的金膜,气体传感器中催化剂固定的碳纳米管以及悬臂梁结构中提高吸附性能的纳米膜等。此外,利用纳米结构的特性,可以制作全新的生物传感器。实际上,生物分子本身就可以看作具有特定功能的纳米器件,如酶分子对底物分子的识别和作用,它可以切断底物分子的化学键并进行重组。细菌视紫红质的蛋白质对光很敏感,当它暴露于光下时会发射出质子,从而产生出可以检测的微小电信号。它对特定频率光的响应受溶液中不同离子浓度的影响,因而可以用来检测离子。
纳米技术在生物传感器的发展趋势是集成多功能、便携式、一次性的快速检测分析机器,可广泛用于食品、环境、战场、人体疾病等领域的快速检测,如食品和饮料中病原体或者农药残留成分的快速灵敏检测,环境中污染气体或者污染金属离子等远程检测和控制,人体血液成分和病原体的快速实时检测,人体健康的长期监测
(
如糖尿病患者血液中糖成分的长期监测等
)
,以及战场生化武器的快速检测
(
如对炭疽病毒的检测等
)
。
多种生物传感器的集成或者生物传感器阵列是生物传感器发展的另一个趋势,例如微电极阵列对二维微环境的检测等。分子自组装聚合物加工的研究呈上升趋势,其加工工艺简单可控,可以实现快速复制,而且成本较低,对生物传感器的发展有很重要的促进作用,有利于高灵敏度、低成本、一次性的纳米生物传感器的发展。
其中生物分子自组装技术更引人注目,如有机生物膜制作的纳米胶囊,由于其天然的生物兼容性、优异的特异结合性能,是生物传感器发展的另一个全新领域。
参考文献:
[1] Ward M D, Ebersole R C. Piezoelectric specific binding assay with mass amplified reagents[P]. US patent: 5501986, 1996
[2] Bauer G, Pittner F, Schalkhammer T h. Metal nano-cluster biosensors[J]. Mikrochim Acta, 1999, 131: 107~114
[3] Maxwell D, Taylor M J, Nie S. Self-assembled nanoparticle probes for recognition and detection of biomolecules[J]. J Am Chem Soc, 2002, 124: 9606~9612
[4] Šafařík I, Šafaříková M. Use of magnetic techniques for the isolation of cells[J]. J Chromatogr B, Biomed Sci Appl, 1999, 722: 33~53
[5] Richardson J, Hawkins P, Luxton R. The use of coated paramagnetic particles as a physical label in a magneto-immunoassay[J]. Biosensors and Bioelectronics, 2001,16: 989~993
[6] Chemla Y R, Grossman H L, Poon Y, et al. Ultrasensitive magnetic biosensors for homogeneous immunoassay[J]. Proc Natl Acad Sci USA, 2000, 97: 14268~14272
[7] González-García M B, Fernández-Sánchez C, Costa-García A. Colloidal gold as an electrochemical label of streptavidin-biotin interaction[J]. Biosensors and Bioelectronics, 2000, 15: 315~321
[8] PSingh A K, Flouders A W, Volponi J V. Development of sensors for direct detection of organophosphates. Part I: immobilization, characterization and stabilization of acetylcholinesterase and organophosphate hydrolase on silica supports[J]. Biosensors and Bioelectronics, 1999, 14: 703~713
[9] Xu X, Liu S, Ju H. A novel hydrogen peroxide sensor via the direct electrochemistry of horseradish peroxidase immobilized on colloidal gold modified screen-printed electrode[J]. SENSORS, 2003, 3: 350~360
[10] Cui Y, Wei Q, Park H, Lieber C M. Nanowire nanosensors for highly sensitive and selective detection of biological and chemical species[J]. SCIENCE, 2001, 293: 1289~1292
[11] Azamian B R, Davis J J, Green M L H, et al. Bioelectrochemical Single-Walled Carbon Nanotubes[J]. J Am Chem Soc, 2002, 124:12664~12665
[12] Aihara K, Xiang J, Apprao R, et al. GHz carbon nanotube resonator bio-sensors[M]. IEEE-NANO 2003, San Fransisco, US: IEEE press, 2003 (2): 612~614
[13] Miao Y, Yuan C. Construction of a glucose biosensor immobilized with glucose oxidase in the film of polypyrrole nanotubes[J]. Analytical Letters, 1999, 32(7): 1287~1290
[14] Lin V S, Motesharei K, Dancil K S, et al. A porous silicon-based optical interferometric biosensors[J]. SCIENCE, 1997, 278:840-843
[15] Tan W H, Shi Z Y, Kopelman R, et al. Submicrometer intracellular chemical optical fiber sensors[J]. SCIENCE, 1992, 258 (5083): 778~781
[16] Barke S L R, Kopelman R. Development and cellular applications of fiber optic nitric oxide sensors based on a gold-absorbed fluorophore[J]. Anal Chem, 1998, 70(23): 4902~4908
[17] Dinh T V, Alarie J P, Cullum B M, et al. Antibody-based nanoprobe for measurement of a fluorescent analyte in a single cell[J]. National Biotechnology, 2000, 18: 764~767
[18] Dinh T V, Griffin G D, Alarie J P, et al. Advanced nanosensors and nanoprobe[M]. USA: Foresight Institute press, 1998, 143~148
[19] Malaquin L, Vieu C, Genevieve M, et al. Nanoelectrode-based devices for electrical biodetection in liquid solution[J]. Microelectronic Engineering, 2004, 73–74: 887~892
[20] McKendry R, Zhang J, Lang H P, et al, Multiple label-free biodetection and quantitative DNA-binding assays on a nanomechanical cantilever array[J]. Proc Natl Acad Sci USA, 2002, 99: 9783~9788
[21] Baselt D R, Lee G U, Colton R J. Biosensor based on force microscope technology [J] . J Vac Sci Technol B. 1996, 14(2): 789~793
[2] Bauer G, Pittner F, Schalkhammer T h. Metal nano-cluster biosensors[J]. Mikrochim Acta, 1999, 131: 107~114
[3] Maxwell D, Taylor M J, Nie S. Self-assembled nanoparticle probes for recognition and detection of biomolecules[J]. J Am Chem Soc, 2002, 124: 9606~9612
[4] Šafařík I, Šafaříková M. Use of magnetic techniques for the isolation of cells[J]. J Chromatogr B, Biomed Sci Appl, 1999, 722: 33~53
[5] Richardson J, Hawkins P, Luxton R. The use of coated paramagnetic particles as a physical label in a magneto-immunoassay[J]. Biosensors and Bioelectronics, 2001,16: 989~993
[6] Chemla Y R, Grossman H L, Poon Y, et al. Ultrasensitive magnetic biosensors for homogeneous immunoassay[J]. Proc Natl Acad Sci USA, 2000, 97: 14268~14272
[7] González-García M B, Fernández-Sánchez C, Costa-García A. Colloidal gold as an electrochemical label of streptavidin-biotin interaction[J]. Biosensors and Bioelectronics, 2000, 15: 315~321
[8] PSingh A K, Flouders A W, Volponi J V. Development of sensors for direct detection of organophosphates. Part I: immobilization, characterization and stabilization of acetylcholinesterase and organophosphate hydrolase on silica supports[J]. Biosensors and Bioelectronics, 1999, 14: 703~713
[9] Xu X, Liu S, Ju H. A novel hydrogen peroxide sensor via the direct electrochemistry of horseradish peroxidase immobilized on colloidal gold modified screen-printed electrode[J]. SENSORS, 2003, 3: 350~360
[10] Cui Y, Wei Q, Park H, Lieber C M. Nanowire nanosensors for highly sensitive and selective detection of biological and chemical species[J]. SCIENCE, 2001, 293: 1289~1292
[11] Azamian B R, Davis J J, Green M L H, et al. Bioelectrochemical Single-Walled Carbon Nanotubes[J]. J Am Chem Soc, 2002, 124:12664~12665
[12] Aihara K, Xiang J, Apprao R, et al. GHz carbon nanotube resonator bio-sensors[M]. IEEE-NANO 2003, San Fransisco, US: IEEE press, 2003 (2): 612~614
[13] Miao Y, Yuan C. Construction of a glucose biosensor immobilized with glucose oxidase in the film of polypyrrole nanotubes[J]. Analytical Letters, 1999, 32(7): 1287~1290
[14] Lin V S, Motesharei K, Dancil K S, et al. A porous silicon-based optical interferometric biosensors[J]. SCIENCE, 1997, 278:840-843
[15] Tan W H, Shi Z Y, Kopelman R, et al. Submicrometer intracellular chemical optical fiber sensors[J]. SCIENCE, 1992, 258 (5083): 778~781
[16] Barke S L R, Kopelman R. Development and cellular applications of fiber optic nitric oxide sensors based on a gold-absorbed fluorophore[J]. Anal Chem, 1998, 70(23): 4902~4908
[17] Dinh T V, Alarie J P, Cullum B M, et al. Antibody-based nanoprobe for measurement of a fluorescent analyte in a single cell[J]. National Biotechnology, 2000, 18: 764~767
[18] Dinh T V, Griffin G D, Alarie J P, et al. Advanced nanosensors and nanoprobe[M]. USA: Foresight Institute press, 1998, 143~148
[19] Malaquin L, Vieu C, Genevieve M, et al. Nanoelectrode-based devices for electrical biodetection in liquid solution[J]. Microelectronic Engineering, 2004, 73–74: 887~892
[20] McKendry R, Zhang J, Lang H P, et al, Multiple label-free biodetection and quantitative DNA-binding assays on a nanomechanical cantilever array[J]. Proc Natl Acad Sci USA, 2002, 99: 9783~9788
[21] Baselt D R, Lee G U, Colton R J. Biosensor based on force microscope technology [J] . J Vac Sci Technol B. 1996, 14(2): 789~793
Nanotechnology And Biosensors
Abstracts:Nanotechnology is playing an increasingly important role in the development of biosensors. The widely use of these nanoparticles (such as
colloidal gold,
magnetic particles,
fluorescent
particles,et al.) has helped bonding of sensitive molecule, signal detection and amplification, analyte enrichment and concentration. Because of its submicron dimensions, nanostructure has special chemical and physical properties improving the detection sensitivity of biosensor, reducing the time of biochemistry reaction, and increasing the detection throughout. The conclusion is given in the paper thatthe new trend of biosensor is nanotechnology.
Keywords:nanotechnology; biosensors; NEMS technology
This work was supported by grants from special support Fee for Biological Science and Technology Research of CAS (NO. STZ-00-03) and Knowledge Innovation Program of CAS (NO. KSCX-06)
作者简介:
邹志青,中国科学院上海微系统与信息技术研究所博士生,现从事于生物微芯片系统的研究。
通讯地址:上海市长宁区长宁路 865 号 8 号楼 706 室
邮编: 200050 联系电话: 86-21-62511070-8706
E-mail : zouzhiqing@mail.sim.ac.cn
赵建龙,中国科学院上海微系统与信息技术研究所研究员,现主要从事生物芯片、生物微芯片系统等研究。
通讯地址:上海市长宁区长宁路 865 号 8 号楼 706 室
邮编: 200050 联系电话: 86-21-62511070-8706
E-mail : zouzhiqing@mail.sim.ac.cn
赵建龙,中国科学院上海微系统与信息技术研究所研究员,现主要从事生物芯片、生物微芯片系统等研究。










评论